Теория объемного заполнения микропор
Как известно, мольный объем b отвечает учетверенному суммарному объему молекул и может быть вычислен по формуле
![]() (3.2.4)
(3.2.4)
Плотность адсорбата в микропорах при критической температуре ркр составит:
pкр=M/1000b (3.2.5)
Таким образом, отношение плотностей адсорбата при нормальной температуре кипения и критической температуре можно аппроксимировать отношением,![]() где p0 - плотность нормальной жидкости при Tкп, а р*кр находится по формуле (3.2.5). Это позволяет вычислить термический коэффициент предельной адсорбции a.
где p0 - плотность нормальной жидкости при Tкп, а р*кр находится по формуле (3.2.5). Это позволяет вычислить термический коэффициент предельной адсорбции a.
В самом деле, при постоянстве предельного адсорбционного объема Wo, т.е. объема микропор, имеем:
для Tкп a0=W0p0 (3.2.6)
для Ткр a0*=W0pкр* (3.2.7)
Отсюда
a0/a0*=p/pкр* (3.2.8)
Согласно (2.2.2) и (2.2.8) получаем:
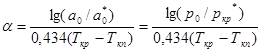 (3.2.9)
(3.2.9)
В основе теории объемного заполнения микропор лежат термодинамические закономерности, и поэтому при описании адсорбционного равновесия используют такие термодинамические функции как энтальпия, энтропия и энергия Гиббса. Для расчета изменений этих функций в качестве стандартного состояния при рассматриваемой температуре принимается объемная жидкая фаза, находящаяся в равновесии с ее насыщенным паром при давлении pS или летучести fS.
Основной термодинамической функцией является дифференциальная максимальная мольная работа адсорбции А, равная со знаком минус изменению энергии адсорбции Гиббса ![]() G:
G:
![]() (3.2.10)
(3.2.10)
или
![]() (3.2.11)
(3.2.11)
где р - равновесное давление; f - летучесть пара при температуре T.
Введение в формулу летучести вместо давления позволяет учесть неидеальность газовой фазы.
Представления об объемном заполнении микропор были развиты вначале для микропористых углеродных адсорбентов или активных углей, для которых определяющее значение в адсорбционном взаимодействии имеют дисперсионные силы. Особенностью большинства промышленных активных углей является легкая доступность микропор для молекул паров веществ, молекулярные массы которых не превышают 150. Поэтому предельные значения адсорбционной способности в микропорах а0 для температур, не превышающих нормальные температуры кипения соответствующих адсорбтивов, в удовлетворительном приближении отвечают значениям предельного объема адсорбционного пространства W0, являющегося константой рассматриваемого микропористого адсорбента
![]() (3.2.12)
(3.2.12)
где r и V - плотности и соответственно мольные объемы нормальных жидкостей при температурах опытов.
В том случае, когда адсорбция определяется действием дисперсионных сил, коэффициенты подобия могут быть достаточно точно оценены как отношение парахора адсорбируемых молекул П к парахору стандартного пара (при адсорбции на активных углях обычно бензола) П0:
![]() (3.2.13)
(3.2.13)
Значения парахоров не зависят от температуры и определяются по соотношению
Еще статьи по экологии
Экологическая обстановка, эколого-природные условия социальной и индивидуальной жизни людей в Алтайском крае
Обеспечение охраны окружающей среды, рационального использования и
воспроизводства природных ресурсов является одним из ключевых общественных
благ, которые формируют основу долгосрочного соц ...
Экологические проблемы городов Красноярского края
В процессе развития человеческой цивилизации города становились средой жизнедеятельности всевозрастающего числа людей. В России 73% населения сосредоточено в городах. В некоторых странах эта доля еще ...
Проект установки для очистки выбросов в атмосферу, образующихся при сжигании топлива
Предприятия, вырабатывающие электрическую и тепловую энергию
на базе органического топлива, называются теплоэлектроцентралями (ТЭЦ).
Почти 2/3 тепловой энергии и остатков бывшего топлива в ...
