Оптимизация химического реактора по экологическим и экономическим критериям
Для нахождения экономически оптимальных факторов получения SO3 из SO2, рассмотрим влияние различных факторов на равновесный состав реакционной смеси.
Химические реакции заключаются во взаимодействии реагентов с образованием продуктов реакции. Химические реакции протекают в прямом и в обратном направлениях. Направление протекания химической реакции определяется условиями ее проведения (температурой, давлением, концентрацией веществ).
Химическое равновесие.
Рассмотрим зависимость химического равновесия от температуры и давления.
В обратимых реакциях скорость прямой реакции вначале имеет максимальное значение, а затем уменьшается вследствие уменьшения концентрации исходных веществ, расходуемых на образование продуктов реакции. Обратная реакция в начальный момент имеет минимальную скорость, которая увеличивается по мере увеличения концентрации продуктов реакции. Следовательно, скорость прямой реакции уменьшается, а обратной увеличивается. Наконец наступает такой момент, когда скорости прямой и обратной реакции становятся равными.
При химическом равновесии концентрации реагентов, температура и другие параметры системы не изменяются во времени. Состояние химического равновесия обратимых процессов количественно характеризуется константой равновесия.
По принципу Ле-Шателье: если на систему, находящуюся в состоянии равновесия оказать внешнее воздействие то система перейдет в другое состояние так чтобы уменьшить эффект внешнего воздействия.
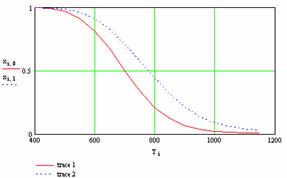
График 1 - Влияние температуры на изменение положения химического равновесия
На графике 1 показана зависимость степени превращения от температуры. Реакция окисления SО2 в SO3 является экзотермической (протекающей с выделением теплоты) т.е. для этой реакции при увеличении температуры равновесная степень превращения SО2 будет уменьшаться. Химическое равновесие по принципу Ле-Шателье смещается в сторону исходных веществ.
химический реактор отходящий газ
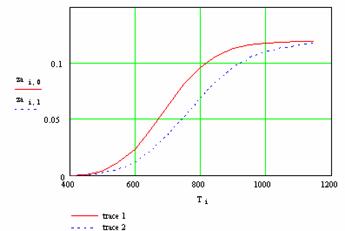
График 2 - Влияние давления на изменение положения химического равновесия
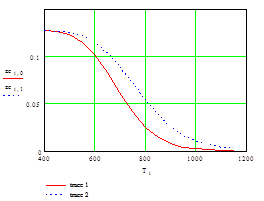
График 3 - Влияние концентрации веществ на положение химической реакции
На графике 2 показана зависимость степени превращения от давления где при увеличении давления равновесная степень превращения смещается в сторону образования продуктов реакции. Следовательно, повышение давления оказывает положительное влияние на течение реакции.
Скорость химической реакции.
Скорость реакции - это величина, показывающая, как изменяется концентрация одного из веществ в единицу времени. Чем больше скорость реакции, тем меньше объем реактора.
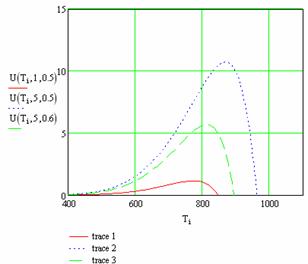
График 4 - Зависимость скорости течения реакции от температуры, давления и степени превращения
На графике 4 видно, что при увеличении температуры скорость реакции сначала возрастает, а затем падает (U(Ti,1,0.5)). Видно, что при заданных параметрах давления и степени превращения, скорость протекания реакции мала.
Увеличиваем давление (U(Ti,5,0.5)) и видим что возрастает скорость протекания реакции и увеличивается температурный диапазон.
Для сравнения с проведенными опытами увеличим степень превращения до 0,6 (U(Ti,5,0.6)) и видим что скорость течения реакции снизилась, также уменьшился температурный диапазон.
Исходя из сделанных теоретических расчетов следует что наиболее выгодным будет вариант (U(Ti,5,0.6)) т.к. не нарушается температурный диапозон проводимой реакции, сохраняется высокая скорость реакции что в свою очередь позволяет использовать реактор небольшого размера.
Расчет объема и оптимальной себестоимости реактора.
Рассмотрим расчеты реакторов работающих в изотермическом и адиабатическом режимах.
Изотермический реактор.
Температура во всем объеме такого реактора равна подаваемой в реактор температуре. Внутри реактора установлен теплообменный элемент за счет которого компенсируется тепловой эффект реакции. Если реакция идет с выделением теплоты то направляем в реактор холодный теплоноситель который нагревается температурой проводимой реакции.
Рассмотрим зависимость объема реактора от глубины протекания реакции (график 5). При базовых значениях VR(750,1,Xi,1) с увеличением степени превращения объем реактора растет. Объем реактора достигает значения 2 при степени превращения 0,5.
Далее увеличиваем температуру в реакторе VR(800,1,Xi,1), равновесие смещается в сторону исходных веществ, скорость с увеличением температуры возрастает, т.е. объем реактора при малых степенях превращения меньше, при больших - больше.
Еще статьи по экологии
Процесс снижения ущерба окружающей среде (на примере ОАО Сургутнефтегаз)
До
настоящего времени анализ безопасности в нефтегазовой промышленности по
существу сводился к чисто инженерным методам достижения технически оправданных
уровней безопасности технологически ...
Парниковый эффект
В
последнее время деятельность человека оказывает беспрецедентное по масштабам и
интенсивности воздействие на окружающую среду и глобальные системы
жизнеобеспечения. Доказательство тому ...
Технология фиторемедиации
Для
обезвреживания ядовитых органических веществ, попадающих в окружающую среду с
отходами химических предприятий, уже давно и довольно успешно используют
различные микроорганизмы. Однако о ...
